生物扫描电镜主要利用二次电子成像拍摄材料的表面三维形貌情况,拍摄照片为黑白照片;一般用来观察细胞外表面的变形以及受损情况等,也可以观察材料在细胞表面的分布情况,广泛应用于检测生物样品、非均相有机材料、无机材料等微米、纳米范围内的表面特征。
送样方式:
可接收固定好的细胞/组织样品并附有详细送检要求的送样单
①需要您提供的样品:收集细胞/组织取样(新鲜迅速取材),置于1.5ml离心管内,加入2.5%的戊二醛溶液(固定液加满离心管,使样品完全浸没在固定液中),放置于4℃保存,请不要倒弃固定液,一般固定12h后可寄送(务必采用1.5ml离心管寄送)。
②打印填写完整的预约单、送样单和样品一起寄送。
样品取材及固定常用方法:
|
细胞类 |
106以上的细胞,用细胞刮刀刮下来,1500-3000转离心,5-10min,收集细胞于1.5ml或2ml离心管,管底肉眼可见2-3粒大米状样品,如果细胞量很多,把细胞团块用细针尖挑成几个小团块,弃上清,沿管壁缓慢加入4℃预冷的固定液,固定液完全浸没样品,可放置于4°C保存。 |
|
组织类 |
新鲜取材,取材位置准确,组织大小尽量在1-2mm³,离体取材后请尽快投入4℃预冷的固定液中,固定液完全浸没组织,可放置于4°C保存。 |
|
细菌类 |
吸取OD0.5-0.8的培养物,离心后弃培养基,收集菌体沉淀于管底黄豆大小,可以用PBS洗1-2次,齐上清,沿管壁缓慢加入4℃预冷的固定液,固定液完全浸没样品,可放置于4°C保存。 |
|
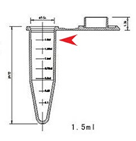
*固定液的量请参考上图,加至箭头所示位置 |
|
 结果展示
结果展示
 常见问题
常见问题-
 扫描电镜制样流程?
扫描电镜制样流程?
新鲜取材后用2.5%戊二醛固定液固定样本,4℃过夜放置,倒掉2.5%戊二醛固定液,用0.1M,pH7.0的磷酸缓冲液漂洗样品三次,每次15min;用1%的锇酸溶液固定样品1-2h;小心取出锇酸废液,用0.1M,pH7.0的磷酸缓冲液漂洗样品三次,每次15min;用梯度浓度(包括30%,50%,70%,80%,90%和95%五种浓度)的乙醇溶液对样品进行脱水处理,每种浓度处理15min,再用100%的乙醇处理两次,每次20 min。用乙醇与醋酸异戊酯的混合液(V/V=1/1)处理样品30min,再用纯醋酸异戊酯处理样品1h或放置过夜。临界点干燥/冷冻干燥处理。镀膜,观察。处理好的样品在扫描电镜中观察。